 |
|
Le marché de la santé au Japon et en Corée du Sud
Impact de la COVID 19
Une situation sanitaire maîtrisée, et un rebond économique en 2021. Quelques chiffres sur le marché de la santé.
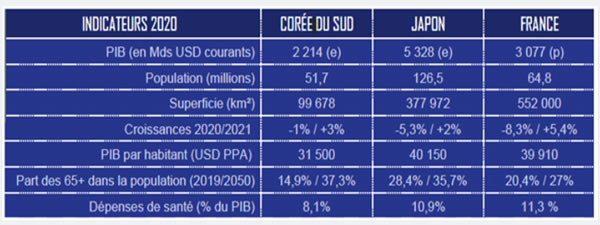
| Japon | Corée du sud | |
| Classement marché santé mondial - Médicaments et biotech - Dispositifs médicaux |
3e 88,8 Mds € 24,2 Mds € |
10e 18,5 Mds € |
| Couverture assurance | universelle | universelle |
| Dépenses médicales | 10,9 % du PIB | 8,1 % du PIB |
| Espérance de vie - % des plus de 65 ans |
84,2 ans 28,4 % |
84,7 ans 24,3 % en 2030 |
Le marché de la santé au Japon
Des grands groupes pharmaceutiques : Takeda, Astellas, Daiichi Sankyo, Chugai, Ono… qui s’ouvrent à l’international et aux partenariats technologiques.
Domaines porteurs : cancers, maladies cardio-vasculaires, maladies chroniques, démence, maladies associés aux modes de vie…
Et pour les dispositifs médicaux : Olympus, Terumo, Canon, Fujifilm… Domaines porteurs : chirurgie robotique, technologies de VR/AR, AI…
Règlementation
Enregistrement sanitaire
Au Japon, les dispositifs médicaux sont réglementés par le Ministry of Health, Labour and Welfare (MHLW) et la Pharmaceuticals and Medical Devices Agency (PMDA). Le MHLW est l’organisme en charge de la création des réglementations relatives aux dispositifs médicaux et médicaments.
La réglementation majeure relative aux dispositifs médicaux est la Law on Assurance of Quality, Efficacy and Safety of Drugs and Medica lDevices, plus couramment appelée Pharmaceuticals and Medical Devices Act(PMD Act).
Les dispositifs médicaux suivent un système de classification basé sur le niveau de risque. Il existe ainsi 4 catégories de dispositifs médicaux. Les procédures réglementaires pour la mise sur le marché des dispositifs médicaux dépendent de la classe à laquelle ils appartiennent.
Accord de libre-échange
Le 1er février 2019 est entré en vigueur l’accord de partenariat économique(APE), conclu le 17 juillet 2018 entre l’Union européenne et le Japon. Les dispositifs médicaux européens bénéficiaient déjà d’un taux de droits de douane nul avant cet accord. Mais celui-ci permet l’adoption par le Japon du système international de normes de gestion de la qualité dans le cadre des négociations et met un terme aux doublons relatifs aux exigences en matière de remboursement des dispositifs et induit une baisse significative des coûts de certification.
Étiquetage
Il n’est pas obligatoire que les informations figurent sur les marchandises lors de leur exportation depuis la France. Généralement, c’est l’importateur japonais qui s’occupe de l’étiquetage.
Le marché de la santé sud-coréen
Des grands groupes pharmaceutiques : Green Cross, Yuhan, Samsung Biologics, Sk Bioscience… Domaines porteurs : cancers, maladies cardio-vasculaires, maladies chroniques, maladies respiratoires…
Et pour les dispositifs médicaux : Samsung Medison, Vatech, et DK Medical (imagerie), Osstem Implant, Seegene, Sd Biosensor…
Domaines porteurs : technologies et matériels d’assistance paramédicale, prothèses (hors dentaire), matériel de diagnostic…
Règlementation
Enregistrement sanitaire
L’autorité en charge du contrôle de l’importation, de la fabrication, de la distribution et de la vente des dispositifs médicaux en Corée du Sud est le Ministry of Food and Drug Safety (MFDS).
Les dispositifs médicaux sont classés en 4 grandes catégories. Les dispositifs médicaux de classe III et IV, de même que certains dispositifs médicaux de classe I ont l’obligation d’être enregistrés en amont de leur importation. Les dispositifs médicaux de classe I sont soumis à une procédure de notification.
Le gouvernement coréen a publié récemment deux documents réglementaires relatifs aux dispositifs médicaux. Les révisions finales sont entrées en vigueur le 17 janvier 2020.
Accord de libre-échange
Depuis l’entrée en vigueur de l’accord de libre-échange entre la Corée du Sud et l’Union européenne, de nombreux produits originaires de l’UE bénéficient de réduction voire d’exemption des droits de douane à l’entrée sur le territoire coréen. C’est le cas des dispositifs médicaux. Outre la DOF (Déclaration d’Origine sur Facture) et le statut d’exportateur agréé, la règle du transport direct et les règles d’origine préférentielles prévues par l’accord doivent être respectées pour bénéficier du tarif préférentiel. Si ces règles ne sont pas respectées, c’est le tarif MFN qui s‘appliquera.
Etiquetage
Les dispositifs médicaux sont soumis à des règles d’étiquetage et d’emballage selon les Regulations on Indication and Labelling of Medical Device.
Propriété intellectuelle
Les deux pays, Japon et Corée du Sud sont très avancés légalement avec une forte protection des innovations. Ils se situent au top 3 pour le Japon et 4 pour la Corée du Sud pour le dépôt de brevets dans le monde.
Pour préparer au mieux vos actions sur ces marchés :
- réfléchir à sa stratégie de protection par pays (possible de déposer un brevet international ou dépôt national auprès du JPO au Japon ou du KIPO en Corée du Sud) ;
- vérifier la liberté d’exploitation d’une marque ou d’un brevet : attention, les alphabets de ces pays étant différents, il faut faire aussi faire une recherche dans les alphabets locaux ;
- comprendre la notion de nouveauté absolue et les délais de priorité, notamment pour les designs et brevets.
Source : Webinaire Business France - 31 mai 2021





